三位科学家因DNA修复分享2015诺贝尔化学奖
管理员 | 2018-05-16 21:30:12
三位科学家因DNA修复分享2015诺贝尔化学奖
2015年10月07日18:02 新浪科技
新浪科技讯 北京时间10月7日消息,2015年度诺贝尔化学奖授予托马斯-林道尔(Tomas Lindahl)、保罗-莫德里奇(Paul Modrich)以及阿奇兹-桑卡(Aziz Sancar),以表彰他们在DNA修复机制方面的研究。

生命的奇迹时刻
从一个细胞到另一个细胞,从一代人到下一代人。决定着我们身体方方面面的基因信息千万年来在我们的体内传递着。尽管时常会遭受到来自周遭环境的各种攻击,但我们的基因仍显示出一种令人惊讶的稳定性。托马斯-林道尔、保罗-莫德里奇以及阿奇兹-桑卡三名科学家被授予2015年度的诺贝尔化学奖,他们的工作揭示了细胞如何进行DNA修复并确保其遗传信息安全的机制。
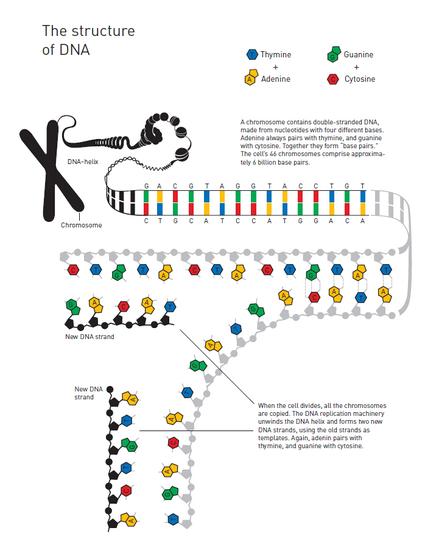
你的身份在来自精子的23条染色体和23条来自卵子的染色体相互结合的那一刻便已经被定义了。这些最初的信息共同组成了你的原始染色体版本,也就是你的遗传信息。
所有构建你所需要的信息都被包含在了其中。如果有人将你的第一个细胞中的DNA分子链抽取出来并拉直,它的长度将达到两米。
随着受精卵开始分裂,DNA分子也会被复制,分裂出来的新细胞将包含有与原始细胞完全一致的遗传信息。在那之后,分裂继续进行:两个变成四个,四个变成八个,在一周之后,你已经有128个细胞组成了,其中的每一个细胞内都包含着完整的遗传信息。此时你身体内全部的DNA分子链条长度即将接近300米长。
今天,在经过数十亿次的细胞分裂之后,你体内的DNA分子链条如果取出来拉直,其长度可以从地球抵达太阳再回到地球,来回大约250次。尽管你最初的DNA信息被复制了那么多次,但它的最新版本与最初受精卵中的原始版本之间的差异却极小。这里正是生命分子展示其伟大之处的时刻,因为从纯粹化学的角度来看,这样的事情几乎是不可能做到的。
所有化学过程都会发生随机误差。除此之外你的DNA分子每天还会受到有害辐射和其他分子相互作用的干扰或破坏。事实上,你应该在发育成胚胎之前就早已陷入化学上的完全混乱状态了。
你身体内的DNA物质受到一组蛋白质的监督。年复一年,我们的DNA完好程度惊人惊叹,这得益于一系列的分子修复机制的保护。这些蛋白质不断核查我们的遗传信息并修复任何发现的错误和损坏。2015年度诺贝尔化学奖的获奖人正是由于在分子层面上揭示了这一基本过程而获奖。他们的系统性工作为我们理解活的细胞如何运作作出了决定性贡献,并加深我们对于一些遗传性疾病、癌症以及衰老现象背后分子机制的了解。
托马斯-林道尔、保罗-莫德里奇和阿奇兹-桑卡各自独立地测定了人体内几种DNA修复机制过程。整个故事要从托马斯·林道尔说起,这位与阿尔弗雷德·诺贝尔同样来自瑞典的科学家。
既然生命存在——那么DNA必定是可以被修复的
“说实话,DNA的稳定性有多高?”1960年代末,托马斯·林道尔开始思考这个问题的答案。当时,科学界相信,作为构成生命现象的基础,DNA分子是极其稳定的,这几乎是毫无疑问的。进化的确需要突变的发生,但这样的突变在每一代都应该非常有限,因为如果遗传信息是不稳定的,那么任何多细胞生命都将不可能存在。在林道尔在美国普林斯顿大学做博士后研究期间,他针对RNA分子开展研究,这种分子是DNA分子的孪生姐妹。
但是事情并非一帆风顺。在实验中,林道尔必须加热RNA,但这样做就不可避免地会造成这种分子的迅速降解。RNA分子比DNA分子更加敏感,这一点是广为人知的,但如果RNA如此容易被加热破坏,DNA分子真的能够在一生的时间里都保持稳定吗?这个想法占据了林道尔的头脑。
数年后,林道尔开始着手探寻这个问题的答案,此时他已经回到瑞典,在斯德哥尔摩的卡罗琳学院任职。一些实验结果已经证明他的这种怀疑并非空穴来风:DNA分子会发生缓慢但明显的降解。林道尔估计认为每天都会发生数以千计对染色体造成破坏的伤害事件,这样的频率显然根本没有办法让人类在地球上存活下去。他从中得到的结论便是,必定存在某种能够修复所有这些DNA损伤的分子系统。有了这个想法之后,托马斯·林道尔开启了通往一扇通往全新研究领域的大门。
去除DNA损伤的特殊酶
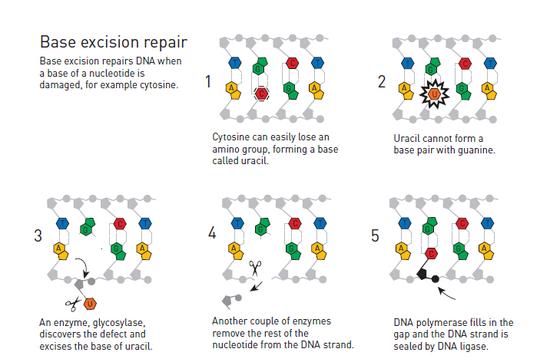
林道尔选择使用细菌DNA开展相关研究,细菌DNA与人类DNA一样是由碱基为基础的几种核苷酸组成的。林道尔开始从中寻找修复酶。DNA的一处化学脆弱环节便是胞嘧啶非常容易丢失一个氨基团,从而造成遗传信息的改变。
在DNA双螺旋结构中,胞嘧啶总是与鸟嘌呤配对,但当这个氨基团缺失时,这个遭受破坏的区域往往就会与腺嘌呤相结合。于是,如果这个缺陷得以持续存在,那么在下一次遗传信息复制发生时,就将发生突变。林道尔意识到,细胞内部必定具备某种机制能够防止这样的事情发生。随后他成功地识别出一种细菌酶,其能够从DNA中清除那些遭受破坏的胞嘧啶。在1974年,林道尔发表了自己的研究成果。
林道尔和碱基切除修复机制
这是林道尔随后35年成功工作的开端,在此期间,林道尔发现并检查了细胞内部的多种DNA修复工具。在1980年代初,因种种机缘,他来到英国工作并在英国皇家癌症研究基金会任职。1986年,他成为新设立的克莱尔霍尔实验室(Clare Hall Laboratory)主管,该实验室后来以其科学创新能力而闻名。逐渐的,林道尔开始拼接起“碱基切除修复”分子机制的图景。这一DNA修复机制中涉及糖苷酶(glycosylases),这种酶与他在1974年发现的那种酶很相似。碱基切除修复同样发生在人体内。在1996年,托马斯·林道尔成功地在试管中重现了人体内的DNA修复机制。
但林道尔也意识到,即便是处于细胞内的保护环境下,DNA分子仍然会不可避免的发生改变。长期以来,人们就已经知晓,一些环境因素,比如紫外线辐射都可能会造成DNA的损坏。而大部分细胞用于修复紫外线造成破坏的机制则是“核苷酸切除修复”机制,这是由出生于土耳其,而活跃于美国的阿奇兹·桑卡最先发现的。
做医生还是去学生物化学?
阿奇兹-桑卡对生命分子的迷恋是他在伊斯坦布尔大学攻读医学学位的时候发展起来的。在毕业之后,桑卡在土耳其做了几年医生,但在1973年他决定去学生物化学。有一种现象引起了桑卡的强烈兴趣:当细菌暴露在致命剂量的紫外线辐射中之后,再用蓝色可见光去照射它们,后者就能立刻恢复过来。桑卡对于这种神奇的现象非常好奇,从化学上看,这种事情究竟是如何出现的?
一个名叫克劳德-鲁普特(Claud Rupert)的美国人此前对这一现象开展过研究,于是阿奇兹·桑卡来到位于美国德克萨斯州达拉斯鲁普特的实验室开展研究。1976年,利用当时还相对粗糙的分子生物学工具,桑卡成功地克隆了修复紫外线DNA损伤的那种酶——光修复酶(photolyase)的基因信息,并成功地让细菌超量产生这种酶。这项工作也成为了他的博士毕业论文,但当时并未能引起人们的特别关注——他三次申请博士后研究职位都遭到了拒绝。在这样的情况下桑卡关于光修复酶的研究不得不暂时停了下来。为了继续开展对DNA修复机制的研究,阿奇兹-桑卡在耶鲁大学医学院找到了一份实验室技术员的工作,这是该领域的顶尖研究机构之一。在这里,桑卡开始了最终将让他获得诺贝尔化学奖的工作。
阿奇兹-桑卡——查明紫外线DNA损伤的细胞修复机制

